Должны ли быть изменены действующие диагностические критерии по диабету?
Имеются важные различия между (1) определением диабета при его идентификации у индивидуума и его клиническими и социальными последствиями в связи с диагнозом и (2) определением диабета для эпидемиологических целей. В первом случае требуется тщательное доказательство с ретестированием на другой день, кроме тех случаев, когда у человека симптомы болезни налицо и глюкоза плазмы однозначно повышена. В то же время для эпидемиологических целей повторные исследования проводятся очень редко. При проведении повторных исследований, приблизительно у 75% людей, у которых был выявлен диабет во время эпидемиологических исследований, подтверждается клинический диабет.
При отсутствии более специфического биологического маркера для определения диабета, исследование глюкозы плазмы крови остаётся основным диагностическим критерием. Есть и другие рассуждения, также влияющие на то, как устанавливается диагноз диабета. Является ли диабет высшей точкой непрерывного распределения глюкозы или отдельным явлением? В то время как гипергликемия является важным прогностическим параметром, является ли он центральным или наиболее важной чертой, определяющей прогноз у людей с гипергликемией? В плане скрининга асимптомных людей, как мы можем наилучшим образом балансировать между медицинскими, социальными и экономическими выгодами и ценами?
Несмотря на то, что эти вопросы до сих пор обсуждаются, сведения о диагностической точке отсечения для диабета были получены из двух источников информации:
- уровень глюкозы плазмы, ассоциированный с риском специфических для диабета микроваскулярных осложнений, в частности ретинопатии.
- распределение глюкозы плазмы среди популяции
1. Осложнения диабета
Появление специфических для диабета осложнений было использовано для получения диагностических точек отсечения для диабета, особенно используя результаты полученных эпидемиологических исследований, которые изучали как распространённость, так и частоту ретинопатии в связи с разбросом уровня глюкозы плазмы.
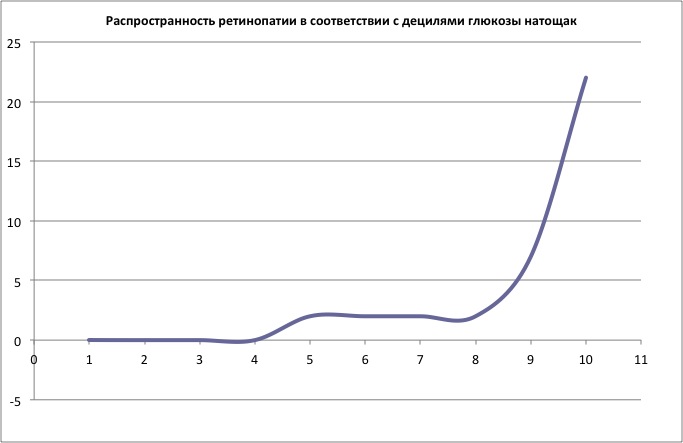 Рисунок 1
Рисунок 1Рисунок 1 показывает пример данных типично используемых для изучения этих взаимоотношений. Значения глюкозы плазмы в оси абсцисс соотносятся с распространённостью ретинопатии в оси ординат. Диагностическая точка отсечения определяется как уровень, при котором риск ретинопатии повышается. Ряд исследований были идеальными для этих целей, но большинство имели ограниченную статистическую силу. Исследования различались по методам, использованным в диагностике ретинопатии, а также по включению и не включению в анализ людей предварительно диагностированных по диабету. Если в анализ включались люди с диабетом, получающие сахароснижающую терапию, сохранялась характеристика популяционных исследований, но вводились ошибки, связанные с эффективностью сахароснижающей терапии. Исключение из анализа людей, получающих терапию по диабету, устраняет ошибки, связанные с эффективностью сахароснижающей терапии, но меняет характеристику популяции с диабетом. Более того, специфическая методология, использованная для получения точки отсечения (т.е. основанная на значениях точки отклонения, или анализе кривой ROC (Receiver Operator Characteristic)), влияет на результат. Рисунок 1 показывает, что распространение ретинопатии резко увеличивается на 9-й дециле глюкозы натощак. Большинство исследований использовали нижнюю границу децили как точку отсечения, но средняя в пределах децилей также может соответствовать выбору точке отсечения.
Результаты, полученные на индейцах Пима, исследования в Египте и неопубликованные результаты NHANES III, цитировались в отчёте ADA 1997 года. Этот анализ включал людей с медикаментозно леченным диабетом. Используя нижнюю границу децили при котором распространённость ретинопатии резко растёт, точки отсечения из этих исследований были 10,3 ммоль/л, 8,6 ммоль/л и 8,5 ммоль/л соответственно для 2-х часовой глюкозы плазмы и 6,1 ммоль/л, 6,0 ммоль/л и 5,9 ммоль/л соответственно для глюкозы плазмы натощак. Использование данных, исключающих больных диабетом, даёт другие результаты: 9,0 ммоль/л, 8,9 ммоль/л и 9,9 ммоль/л соответственно для 2-х часовой глюкозы плазмы и 6,0 ммоль/л, 6,1 ммоль/л и 6,4 ммоль/л соответственно для глюкозы плазмы натощак.
В одном исследовании сообщалось о точках отсечения для глюкозы натощак и 2-х часовой глюкозы плазмы в случаях ретинопатии. При наблюдении более, чем 11 лет, развитие ретинопатии возросло при точке отсечения глюкозы плазмы натощак 7,0 ммоль/л и 2-х часовой глюкозы плазмы 13,3 ммоль/л.
В процессе подготовки этого обзора, попытки найти доказательные взаимосвязи между глюкозой плазмы и биопсией, подтверждающей почечную патологию, были безуспешными. Исследования по взаимоотношению между глюкозой плазмы и менее специфичным маркером диабетического поражения почки, протеинурией, показали некоторые ассоциации, но не такие сильные, как при ретинопатии.
Ряд исследований анализировали взаимоотношения между глюкозой плазмы, смертностью и кардиоваскулярными осложнениями, но не смогли показать чётких порогов, которые могли бы быть использованы в определении диабета.
2. Распределение глюкозы плазмы среди населения
Рисунки 2 и 3 демонстрируют два различных распределения глюкозы плазмы – унимодальное распределение, в котором все население представлено единственным пиком, и бимодальное распределение, в котором население может быть разделено на две отдельные, но перекрывающие друг друга группы. При бимодальном распределении точка пересечения двух кривых используется для разделения нормы от патологии. Необходимо подчеркнуть, что принятие точки отсечения для разделения двух компонентов бимодального распределения глюкозы плазмы необязательно влечёт за собой биологические и патогенетические последствия для здоровья, которые имеют отношение к диабету.
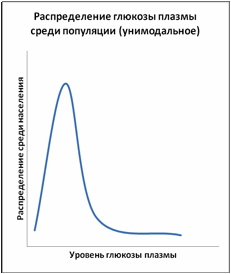 Рисунок 2
Рисунок 2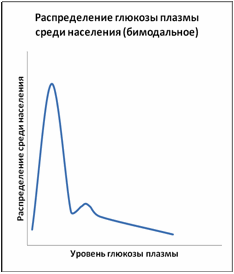 Рисунок 3
Рисунок 3Бимодальное распределение концентрации глюкозы плазмы впервые было описано в 1971 году на индейцах Пима, а впоследствии и на других популяциях в высоким распространением диабета, включая жителей островов Тихого Океана, Азиатских индейцев, Мексиканских американцев и Малазийцев. Недавно бимодальность также была описана у пожилых белых жителей Калифорнии.
В популяции с бимодальным распределением точка отсечения глюкозы плазмы показывает вариации между исследованиями. Например в исследовании Rancho Bernardo и в Малазийском исследовании было сообщено об одинаковой точке отсечения для 2-х часовой глюкозы плазмы в пределах от 11,1 ммоль/л до 13,3 ммоль/л (в зависимости от возрастной группы). Тем не менее, анализ результатов DETECT-2 из 26 различных стран с определением глюкозы плазмы показал широкие вариации в точках отсечения. Точки отсечения для различных стран для концентрации глюкозы натощак варьировал от 5,7 ммоль/л до 8,5 ммоль/л (средняя 7,1 ммоль/л) и для 2-х часовой глюкозы плазмы – от 9,1 ммоль/л до 17,9 ммоль/л (средняя 12,4 ммоль/л).
В заключение следует отметить, что имеется огромное количество данных свидетельствующих, что гипергликемия вредна. Тем не менее, полученные данные недостаточны и имеются ограничения в используемой методологии для извлечения точек отсечения, при которых этот уровень вреда специфично возрастает и чётко дифференцирует диабет о недиабета.
Рекомендация 1
Действующий диагностический критерий ВОЗ для диабета должен быть сохранен – уровень глюкозы плазмы натощак ≥ 7,0 ммоль/л (126 мг/дл) или уровень 2-х часовой глюкозы плазмы ≥ 11,1 ммоль/л (200 мг/дл)
Несмотря на ограниченность данных, из которых были извлечены диагностические критерии для диабета, действующие критерии определяют группу со значительным увеличением преждевременной смертности и повышенным риском микроваскулярных и кардиоваскулярных осложнений.
Как определять нормальный уровень глюкозы плазмы?
Прежде чем дать определение промежуточной гипергликемии, необходимо дать определение нормальной толерантности к глюкозе. Трудно дать ответ на, на первый взгляд, кажущийся простым вопрос. Каждая публикация АДА при определении критериев диагностики диабета давала определение нормальному уровню глюкозы плазмы. В 2003 году АДА дала определение нормальному уровню глюкозы плазмы натощак < 5,6 ммоль/л (< 6,1 ммоль/л в 1997 году) и нормальную 2-х часовую глюкозу плазмы как < 7,8 ммоль/л. В отчёте ВОЗ 1999 года нормальная глюкоза плазмы натощак была < 6,1 ммоль/л и нормальная 2-х часовая глюкозу плазмы < 7,8 ммоль/л.
Трудности в определении нормы отражают трудности с определением диагностических точек отсечения для промежуточной гипергликемии, т.е. нахождение точки отсечения на переменной величине. Более того, такие факторы как возраст, пол и этническая принадлежность имеют отношение к определению нормы. Также, новые данные, полученные в исследованиях, могут привести к изменению нормальных значений. Новые подходы могут использоваться для определения нормальных значений глюкозы.
Статистический подход – распределение глюкозы в популяции
Этот метод чаще всего используется в клинической практике для определения нормальных уровней лабораторных тестов. Применение этого метода требует унимодального распределения среди «здоровой» популяции. Верхняя граница нормы обычно определяется как средняя плюс два стандартных (среднеквадратических) отклонения, и, по определению этот подход означает, что у 2,5% населения имеются нарушения – ситуация, которая не соответствует высокой распространённости патологии, как диабет.
Клинический подход – риск нежелательных исходов
Проспективные популяционные исследования обеспечивают информацией о связи уровня глюкозы плазмы и риска смерти, кардиоваскулярными заболеваниями, раком, развитием диабета.
Levitan провели метаанализ 38 проспективных исследований и подтвердили, что гипергликемия в недиабетических пределах ассоциировалась с повышением риска фатальных и нефатальных кардиоваскулярных заболеваний, та же связь была установлена с уровнем глюкозы плазмы натощак и 2-х часовым уровнем глюкозы. В 12 исследованиях по уровню глюкозы плазмы натощак и 6 исследованиях по 2-х часовому уровню глюкозы было показано, что кардиоваскулярные эпизоды увеличивались в линейном отношении с 2-х часовым уровнем глюкозы в пределах ниже диагностического порога для диабета, тогда как для уровня глюкозы плазмы натощак порог в 5,5 ммоль/л был приемлемым.
Парижское проспективное исследование показало J-образное отношение по всем видам смертности как с уровнем глюкозы натощак, так и с уровнем 2-х часовой глюкозы, а самый низкий уровень смертности наблюдался в интервалах, центрированных на 5,5 ммоль/л для уровня глюкозы натощак и 5,0 ммоль/л для 2-х часовой глюкозы. Что касается смертности от сердечнососудистых заболеваний, то была отмечена линейная зависимость с уровнем глюкозы натощак, а зависимость от уровня 2-х часовой глюкозы моделировалась J-образной кривой, где самая низкая смертность была в интервалах, центрированных на 6,0 ммоль/л.
Исследования, проведённые группой DECODE показали, что J-образное соотношение между смертностью и уровнем глюкозы с самой низкой частотой для тощаковой глюкозы было в пределах 4,50-6,09 ммоль/л. Такое же соотношение отмечалось и для 2-х часовой глюкозы. Самая низкая частота всех видов смертности, кроме кардиоваскулярной была в пределах 4,51-5,50 ммоль/л. А соотношение между кардиоваскулярной смертностью и 2-х часовой глюкозой плазмы было таково, что самая низкая смертность была при самом низком показателе 2-х часовой глюкозы плазмы.
В исследовании Whitehall, с 33-х летним периодом наблюдения, в котором ОТТГ (оральный тест толерантности к глюкозе) с 50 г глюкозы на 17 869 мужчинах в возрасте от 40 до 64 лет в 1967-1969 годах сообщалось о пороговой модели, где начиная с определённого уровня нисходящяя линия лучшим образом описывающет отношение 2-х часовой глюкозы с риском смертности. Угроза коронарной смертности росла по линейной кривой от порога в 4,6 ммоль/л. При 2-х часовом уровне гликемии в 11,1 ммоль/л, адаптированном по возрасту, угроза смерти была в 3,6 раза выше, по сравнению с уровнем гликемии 4,6 ммоль/л. Это градуированное соотношение сохранялось и снизилось на 45% после установления базальной линии по ишемической болезни сердца, ИМТ, систолическому артериальному давлению, холестерину крови, курению, физической активности, функции лёгких и степени занятости.
В длительном проспективном Балтиморском исследовании все виды смертности значительно увеличивались при тощаковой глюкозе плазмы выше 6,1 ммоль/л. При 2-х часовой глюкозе плазмы выше 7,8 ммоль/л риск смерти также значительно возрастал. Высокий уровень глюкозы плазмы также характеризовался с риском раковых заболеваний. Когортное исследование, проводившееся на 1,3 млн. человек в течение 10 лет показало возросший риск ко всем видам рака при увеличении глюкозы сыворотки выше 6,1 ммоль/л.
Также затруднительно определить уровень глюкозы, при котором риск развития диабета чётко бы вырос. Исследования, проведённые в Израиле на группе молодых мужчин, показали, что риск развития диабета прогрессивно вырос при тощаковой глюкозе плазмы 4,8 ммоль/л по сравнению с глюкозой натощак 4,5 ммоль/л.
Все эти исследования, к сожалению, не дают чёткого ответа на вопрос, что же считать нормогликемией, но ясно одно – наименьший риск нежелательных исходов наблюдается при уровнях глюкозы ассоциированных с очевидно здоровыми людьми.
Физиологический подход
Ряд исследований изучали физиологическую секрецию инсулина у людей с недиабетическим уровнем глюкозы плазмы натощак (< 4,5 ммоль/л) и описали границы патологии.
Godsland описали, что первая фаза инсулинового ответа у недиабетических индивидуумов начинает снижаться с уровня глюкозы плазмы натощак 5,0-5,4 ммоль/л, а поздняя фаза инсулинового ответа начинает снижаться при гликемии натощак выше 6,0 ммоль/л. Исследования Piche показали прогрессивное снижение показателей бета-клеточной функции и чувствительности к инсулину даже в пределах гликемии натощак, считавшейся нормальной. При сравнении лиц, у которых уровень гликемии натощак был ниже 4,9 ммоль/л с лицами, у которых уровень гликемии натощак был в пределах 5,3-6,1 ммоль/л было обнаружено, что у последних инсулинорезистентность была выше, также была повышенная реакция инсулина и С-пептида в ответ на ОТТГ и снижена секреция инсулина. Даже у людей с гликемией натощак в пределах 4,9-5,3 ммоль/л выявлены нарушения секреции инсулина и снижена чувствительность к инсулину по сравнению с лицами с более низкими показателями гликемии натощак.
Рекомендация 2
В связи с отсутствием достаточных данных для более точного определения нормального уровня глюкозы, термин «нормогликемия» должен использоваться для уровней глюкозы, ассоциированных с низким риском развития диабета или кардиоваскулярных заболеваний, а это – уровни глюкозы ниже тех, которые были использованы для определения промежуточных гипергликемий.
Как определять нарушенную толерантность к глюкозе?
В 1979 году Американская национальная группа по изучению диабета рекомендовала категорию нарушенной толерантности к глюкозе (НТГ), чтобы обратить внимание на состояние повышенного риска прогрессирования в диабет, в то же время было отмечено, что у многих это состояние вернется к норме. Этот термин был введён, чтобы снять ярлык диабета с других терминов бывших в обиходе в то время для того, чтобы обозначить дистанцию между нормой и диабетом. Было также признано, что у людей с НТГ повышен риск кардиоваскулярных заболеваний. Эта категория и определение также присутствовали в отчёте ВОЗ 1980 года. НТГ не является клиническим состоянием, а является фактором риска диабета и/или нежелательных исходов. Исследования показывают, что НТГ ассоциируется с мышечной инсулинорезистентностью и секрецией дефективного инсулина, в результате чего происходит менее эффективное распределение глюкозы во время теста толерантности к глюкозе (ОТТГ).
Распространённость НТГ различная между популяциями, а также в различных возрастных группах. Чаще это состояние более распространено среди женщин, чем среди мужчин и частота его составляет 10% и более. В исследовании DECODE было показано его увеличение с возрастом. Так, преобладание изолированного НТГ возрастает с 2,9% в мужской возрастной группе 30-39 лет до 15,1% в возрастной группе 70-79 лет и с 4,5% в женской возрастной группе 30-39 лет до 16,9% в группе 70-79 лет. Подобное наблюдается в азиатской популяции, где преобладает НТГ в возрасте 70-89 лет. Тем не менее, в Индийской популяции распространённость НТГ довольно высокая и незначительно меняется с возрастом.
Данные Mauritius указывают, что за 11 лет наблюдения 30% лиц с изначальным состоянием НТГ перешли в норму, 35% оставались с НТГ, 5% перешли группу нарушенной глюкозы натощак и у 30% развился диабет.
Воспроизводимость НТГ при ретестировании в течение 6 недель оценивается как средняя. Доля людей, классифицированных с НТГ при первом тестировании на толерантность к глюкозе и при ретестировании составила 33-48%, примерно такая же доля людей – 39,3-46,2% была переклассифицирована, как здоровые люди и у 6-12,6% при ретестировании обнаружили диабет.
Первоначально НТГ определялась как гликемия, ассоциированная с повышенным риском развития диабета, но сейчас НТГ все больше ассоциируется со значительным риском смертности и кардиоваскулярной патологии.
Исследования McMaster свидетельствуют о следующем:
- относительный риск прогрессирования в диабет у человека с НТГ был в 6 раз выше, чем у человека с нормально толерантностью к глюкозе. Этот относительный риск был в 12 раз выше у людей как с НТГ, так и с НГН.
- относительный риск общей смертности у людей с НТГ был в 1,48 раза выше, чем у здоровых людей. Относительный же риск фатальных кардиоваскулярных исходов выше в 1,66 раза.
Обоснованность действующего определения НТГ
Настоящее определение основывается на риске развития диабета или риске нежелательных исходов, ассоциированных с 2-х часовым уровнем глюкозы плазмы. Точка отсечения в 7,8 ммоль/л для определения НТГ первоначально была получена в результате исследования на индейцах Пима по риску развития сахарного диабета. Разброс частоты развития диабета варьировал меньше, чем 2,0% в год у тех, чей уровень 2-х часовой глюкозы плазмы был на уровне < 5,6 ммоль/л, до 6,8% в год – у тех, чей уровень варьировал 7,8-11,0 ммоль/л. Последующий анализ шести проспективных исследований показал частоту диабета у людей с НТГ от 35,8 до 87,3 человек на тысячу человек в год. Частота возрастала с повышением уровня глюкозы натощак и индекса массы тела.
В отличие от результатов, упомянутых в секции по НГН, определение НТГ было подкреплено относительно небольшим количеством исследований по соответствию широко используемого уровня 2-х часовой глюкозы плазмы 7,8 ммоль/л (140мг/дл). Исследования на индейцах Пима показали, что риск развития в будущем диабета постепенно растёт по мере роста уровня глюкозы, но риск значительно возрастает на интервале превышения нормального уровня глюкозы до 10%. Частота развития диабета в течение 5 лет составила 24% у людей с НТГ, 37% – людей с НГН и лишь 3,6% у здоровых людей.